Osady a komfort użytkowania soczewek kontaktowych
Jakie jest znaczenie kliniczne osadów gromadzących się na soczewkach kontaktowych i czy mogą one być korzystne? Anna Sulley przedstawia nowe wyniki badań zaprezentowane na sesji specjalnej podczas konferencji klinicznej BCLA 2015.
Po pojawieniu się pierwszej jednodniowej soczewki kontaktowej w 1995 roku wydawało się, że epoka obaw związanych z osadami gromadzącymi się na soczewkach kontaktowych dobiega końca. Od czasu wprowadzenia schematów częstej wymiany, soczewek nie odsyła się do gabinetów w celu przeprowadzenia gruntownego czyszczenia lub regularnego usuwania osadów białkowych. Uznano, że mechaniczne czyszczenie przez pocieranie i spłukiwanie soczewek wielokrotnego użytku oraz przestrzeganie schematów wymiany pozwoli utrzymać poziom osadów pod kontrolą.
Dwadzieścia lat później zainteresowanie tym zagadnieniem ponownie wzrosło. Lepiej poznaliśmy interakcje pomiędzy osadami na powierzchni soczewki a okiem oraz charakterystykę różnych osadów na nowoczesnych materiałach. W ramach Konferencji Klinicznej w 2015 roku, Brytyjskie Stowarzyszenie Soczewek Kontaktowych (BCLA) zorganizowało sesję edukacyjną, podczas której przedstawiono informacje, które mogą zmienić nasze podejście do osadów.
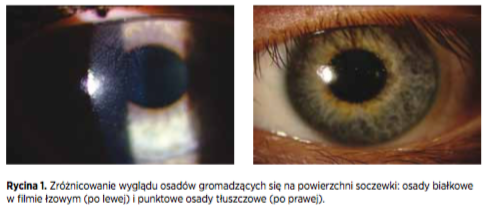
Podczas otwarcia sesji, profesor Philip Morgan (University of Manchester) stwierdził, że w warunkach klinicznych mamy do czynienia z różnym wyglądem osadów: od punktowego i grudkowatego do warstwowego (jak w przypadku osadów białkowych w filmie łzowym) (Rycina 1). Główne składniki osadów stanowią białka i tłuszcze.
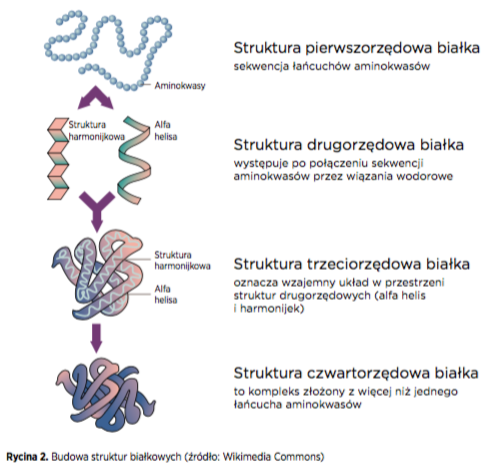
Film łzowy zawiera duże ilości białek zbudowanych z łańcuchów aminokwasów, które mogą wchodzić w interakcje z innymi łańcuchami aminokwasów tworząc złożone trójwymiarowe struktury (Rycina 2). Analiza budowy tych struktur pozwoliła nam zrozumieć zjawiska, które obserwujemy klinicznie.
Istotne jest to, że kształt i struktura białek mogą się zmieniać zarówno w filmie łzowym jak i na powierzchni soczewki, co powoduje przejście białka ze stanu „pierwotnego” lub „aktywnego” do stanu „zdenaturowanego ” lub „nieaktywnego”. Kiedy białko ulega denaturacji, jego zdolność do spełniania naturalnych funkcji ulega zmianie.
Najlepiej poznanym białkiem stanowiącym składnik łez jest lizozym, który wraz z lipokaliną, laktoferryną i immunoglobulinami IgA występuje w dużych ilościach w filmie łzowym, a jego stężenie wynosi w przybliżeniu 2 mg/ml. Zidentyfikowano wiele innych białek występujących w filmie łzowym, jednak ich stężenia są znacznie niższe (poniżej 0,1 mg/ml).
Duże znaczenie miało uwzględnienie wpływu, jaki na białka wywiera umieszczenie soczewki kontaktowej w filmie łzowym. Wiele soczewek kontaktowych ulega „nasączeniu białkami” w ciągu kilku minut od założenia, twierdzi profesor Morgan, jednak większość białek jest przezierna i staje się widoczna dopiero w wyniku procesu denaturacji i zmian struktury, która sprawia, że stają się one półprzejrzyste.
Lizozym jest białkiem o właściwościach antybakteryjnych, oddziałuje na ściany komórkowe bakterii poddając je hydrolizacji i doprowadzając do obumierania bakterii. W tym procesie krytyczne znacznie ma kształt struktury białka.
Dwie sekwencje aminokwasów występujące w lizozymie w postaci pierwotnej znajdują się w idealnej pozycji, co umożliwia powyższe oddziaływanie. Po denaturacji białka, umiejscowienie aminokwasów nie jest już optymalne, a lizozym traci skuteczność zwalczania bakterii.
Różnice dotyczące materiałów
Kolejną istotną obserwacją było to, że na poszczególnych materiałach, z których wykonane są soczewki kontaktowe, gromadzą się różne ilości białek. Materiały z grupy IV (o średniej i wyższej zawartości wody, jonowe) np. etafilcon A (Johnson & Johnson Vision Care), przyciągają stosunkowo duże ilości białek, jednak większe znaczenie kliniczne ma charkterystyka osadów.
Na powierzchni i w strukturze soczewki wykonanej z etafilconu A, dużo większa część białek zachowuje postać pierwotną (ponad 90 procent w przypadku soczewek ACUVUE® 2). Na niektórych materiałach, takich jak lotrafilcon B (Air Optix Aqua, Alcon), ilość osadów białkowych jest mniejsza, jednak tylko niewielka ich część zachowuje aktywną postać (mniej niż 10 procent).
Profesor Morgan stwierdził, że zakres aktywności lizozymu jest zaskakująco szeroki, a pomiędzy materiałami występują wyraźne różnice, które mogą mieć znaczenie kliniczne.
Przechodząc do osadów tłuszczowych (czasami określanych jako „galaretowate guzki” (jelly bumps) kiedy mają postać punktową, a nie formę jednolitej warstwy), należy stwierdzić, że w filmie łzowym występują setki lub nawet tysiące różnych białek, ale o wiele mniej typów tłuszczów. Obejmują one steroidy takie jak cholesterol, nasycone i nienasycone kwasy tłuszczowe, glicerydy i lipidy polarne. Funkcje tłuszczów również mogą ulegać zmianie, jednak dzieje się to w wyniku utleniania i zmian degradacyjnych, a nie w wyniku procesu denaturacji.
Tak jak w przypadku białek, interakcja tłuszczów z poszczególnymi materiałami, z których są wykonane soczewki jest zróżnicowana. Na etafilconie A osadza się bardzo niewielka ilość tłuszczów (cholesterol, kwas oleinowy i ester metylowy kwasu oleinowego), w porównaniu z niektórymi materiałami silikonowo-hydrożelowymi (SiH) i niektórymi materiałami hydrożelowymi z grupy II (średnia i wysoka zawartość wody, niejonowe).
Ewolucja poglądów
W ramach prób opracowania klasyfikacji wyglądu klinicznego osadów gromadzących się na soczewkach kontaktowych w latach siedemdziesiątych XX wieku opracowano między innymi skalę Rudko.
W pracy zatytułowanej Essential Contact Lens Practice, Veys, Meyler i Davies podali propozycję systemu oceny osadów pod względem ilości (stopnie I-IV), rodzaju (krystaliczne, grudkowate, błoniaste-mętne, płytkowe) i wielkości (procent pokrytej powierzchni).
Czy możemy jednak zaufać wynikom obserwacji w lampie szczelinowej, skoro zaobserwowane ilości białek mogą nie być zgodne z ich zmierzoną ilością? Istnieją dowody kliniczne wskazujące, że wysokie poziomy widocznych osadów powodują obniżenie ostrości wzroku przy niskim kontraście, jednak nie ma zbyt wielu dowodów potwierdzających związek pomiędzy wzrostem ilości osadów a obniżeniem komfortu noszenia soczewek.
Zespół profesora Morgana zajmował się ostatnio badaniem właściwości przeciwbakteryjnych filmu łzowego pobranego z soczewek kontaktowych i przeciwdziałaniem denaturacji białek za pomocą płynów do pielęgnacji soczewek. Badacze stwierdzili, że białka pobrane z filmu łzowego wykazywały „niezwykle silny efekt biobójczy” w stosunku do bakterii Pseudomonas aeruginosa, a wskaźnik zniszczenia drobnoustrojów wynosił 6-7 log.
Wymagany poziom skuteczności dla roztworów do dezynfekcji soczewek kontaktowych to zmniejszenie populacji drobnoustrojów w ciągu jednej nocy o 3 log (czyli tysiąckrotnie). „Białka pochodzenia naturalnego znajdujące się w soczewce kontaktowej wykazywały właśnie taki poziom skuteczności niszczenia drobnoustrojów, a w przypadku wielu pacjentów jest on jeszcze wyższy”. Prof. Morgan stwierdził, że „Jest to niezwykle istotne i sugeruje, że duża ilość funkcjonalnych białek występujących w filmie łzowym osadzająca się na materiale soczewki kontaktowej może wykazywać korzystne właściwości”.
Badanie wykorzystujące skaningową kalorymetrię różnicową wykazało, że pojedynczy roztwór uniwersalny (system podwójnej dezynfekcji zawierający biguanid polyaminopropylu i poliquaternium) jest w stanie chronić naturalną postać białek występujących w filmie łzowym lub nawet odwrócić proces denaturacji powodując dodatni efekt antydrobnoustrojowy.
Wystąpienie zakończono stwierdzeniem, że być może przyszedł czas, aby spojrzeć inaczej na osady na powierzchni soczewki.
Istotne czynniki
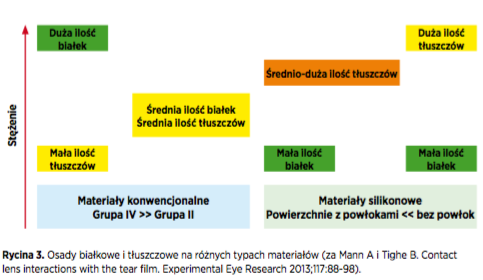
Dr Lakshman Subbaraman (University of Waterloo, Kanada) opracował zestawienie czynników wpływających na gromadzenie się osadów na soczewkach kontaktowych. Według niego, właściwości materiału, z którego wykonana jest soczewka odgrywają „ogromną rolę” (Rycina 3). Na materiałach o właściwościach jonowych osadzały się wyższe ilości białek, a większe pory w strukturze materiału pozwalały na przenikanie osadów głębiej do wnętrza soczewki.
Modyfikacja powierzchni soczewek silikonowo- hydrożelowych zmniejszała zarówno ilość osadów tłuszczowych jak i białkowych, w porównaniu do materiałów bez powłok na powierzchni, chociaż różnice zdawały się nie mieć znaczącego wpływu na aspekt kliniczy. Kolejnym istotnym czynnikiem była wielkość osadów i przenoszony przez nie ładunek, mniejsze cząsteczki białka łatwiej osadzały się na powierzchni soczewki i w większym zakresie przenikały do wnętrza jej struktury.
Lizozym jest głównym białkiem osadzającym się na soczewkach kontaktowych i stanowi 40 procent łącznej liczby białek. Cechuje go mała wielkość cząsteczek i dodatni ładunek, co pozwala na łatwe osiadanie na składnikach materiału o dużej zawartości wody i ładunku ujemnym.
Jak wykazano, to jakość lizozymu (postać pierwotna lub po denaturacji), a nie jeg łączna ilość, jest skorelowana z komfortem noszenia soczewek kontaktowych. Zmniejszenie ilości aktywnej postaci lizozymu było skorelowane z obniżeniem komfortu noszenia soczewek.
Na denaturację białek może wpływać wiele czynników. Wiek soczewki, czynniki środowiskowe, stosowane płyny do pielęgnacji soczewek wykonanych z określonych materiałów mogą wpływać na utratę aktywnych wiązań lizozymu i doprowadzić do obniżenia komfortu. Białko, które uległo denaturacji może również działać jak antygen i zapoczątkować odpowiedź immunologiczną w spojówce, co prowadzi do brodawkowego zapalenia spojówki związanego z noszeniem soczewek kontaktowych (CLPC).
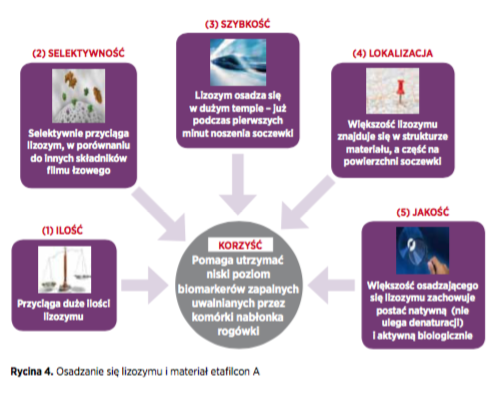
Większość przeprowadzonych dotychczas badań skupiała się na ilości białek gromadzących się na soczewkach kontaktowych. Metody opracowane i udoskonalone na Uniwersytecie Waterloo pomogły badaczom w lepszym poznaniu charakterystyki osadów i zidentyfikowaniu czterech kolejnych istotnych czynników: selektywności, prędkości, lokalizacji i jakości (Rycina 4).
Co ciekawe, przedmiotem niedawnych badań był wpływ tych czynników na homeostazę rogówki, a w szczególności na procesy zapalne. W ramach wspomnianych badań zastosowano najnowsze technologie wykorzystujące zjawisko elektrochemiluminescencji (Meso Scale Discovery) w celu wykazania (po raz pierwszy w historii) korelacji w warunkach in vitro pomiędzy lizozymem po denaturacji a odpowiedzią zapalną obserwowaną na modelu nabłonka rogówki.
Badacze odkryli, że na materiałach hydrożelowych z grupy IV w warunkach in vitro osadzają się bardzo duże ilości lizozymu (ponad 200 mg/soczewce po 16 godzinach inkubacji), w porównaniu do innych materiałów (mniej niż 20 mg/soczewce). Na soczewkach wykonanych z etafilcon A lizozymu osadzało się ponad 500 mg/soczewce. Materiały z tej grupy selektywnie przyciągały lizozym, a nie inne składniki filmu łzowego (stanowił on ponad 90% ogólnej ilości białek), w porównaniu do pozostałych materiałów (od 40% do 60%).
Tempo osadzania się lizozymu było wysokie, a mierzalne ilości wykrywano już w pierwszej minucie od rozpoczęcia inkubacji. Praktycznie cały lizozym osiadający na etafilconie A miał aktywną postać i był równomiernie rozprowadzony w strukturze soczewki i na powierzchni materiału, czyli nie gromadził się wyłącznie na powierzchni. Lizozym znajdujący się na powierzchni etafilconu A częściej zachowywał postać aktywną niż na powierzchni innych materiałów.
W celu zbadania korzyści klinicznych związanych z opisanymi wyżej właściwościami dla modelu in vitro, zespół przeprowadził pierwsze tego rodzaju badanie sprawdzające wpływ lizozymu po denaturacji na komórki nabłonka ludzkiej rogówki. Stwierdzono, że w odróżnieniu od aktywnej postaci lizozymu, postać zdenaturowana zmniejszała aktywność metaboliczną komórek nabłonka i mogła doprowadzić również do zmian funkcji komórkowej, chociaż nie miała właściwości toksycznych i nie powodowała apoptozy komórek. Zdenaturowany lizozym powodował uwalnianie przez komórki rogówki biomarkerów reakcji zapalnej znanych jako cytokiny.
Chociaż znaczenie postaci osadów białkowych było znane od dawna, po raz pierwszy wykazano wpływ lizozymu po denaturacji na komórki rogówki.
Korzystny wpływ
Doktor Subbaraman wyjaśnił również, że dotychczas sądzono jakoby osady tłuszczowe miały niekorzystny wpływ na użytkowanie soczewek kontaktowych, ponieważ zwiększały ryzyko adhezji bakterii, uruchamiały potencjalną odpowiedź immunologiczną i zmieniały właściwości powierzchni soczewki, co powodowało obniżenie komfortu noszenia.
Jednak podczas międzynarodowych warsztatów dotyczących dyskomfortu związanego z użytkowaniem soczewek kontaktowych prowadzonych przez Stowarzyszenie Filmu Łzowego i Powierzchni Oka (TFOS) stwierdzono, że tylko trzy wykonane dotychczas badania powiązały komfort z osadami tłuszczowymi, a korelacja pomiędzy osadzaniem się cholesterolu a komfortem noszenia była bardzo niska.
Zespół z Uniwersytetu Waterloo badał osady tłuszczowe powstające po 14 dniach noszenia soczewek ACUVUE OASYS® przez użytkowników wykazujących objawy oraz bezobjawowych i odkrył, że znacznie większe ilości osadów tłuszczowych (cholesterolu, estrów cholesterolu i trioleiny) stwierdzano w grupie użytkowników bezobjawowych.
Chociaż niezbędne są dalsze badania, uzyskane dotychczas dane wskazują, że selektywna adsorpcja niektórych tłuszczów w określonych ilościach może poprawiać komfort noszenia soczewek kontaktowych.
Pojawiły się również nowe wyniki badań nad właściwościami antybakteryjnymi osadów gromadzących się na soczewkach. Wcześniej uważano, że wszystkie osady powodują intensywniejsze przyleganie bakterii do soczewki kontaktowej. Wykazano jednak, że laktoferryna osadzająca się na soczewce kontaktowej skutecznie obniża żywotność bakterii Pseudomonas aeruginosa przyczepionych do powierzchni soczewki kontaktowej.
Badanie prowadzone we współpracy z badaczami na University of New South Wales w Australii wykazało, że obecność osadów laktoferryny obniżała żywotność bakterii, chociaż ich liczba była wyższa. Stwierdzono, że cholesterol występujący w roztworach ma działanie antybakteryjne, chociaż nie jest dotychczas jasne, czy cholesterol znajdujący się na soczewkach kontaktowych wykazuje podobne właściwości.
Dr Subbaraman stwierdził, że „nie wszystkie osady są złe”, a osiadanie na soczewce określonych składników filmu łzowego może przynosić korzyści.
Zagadnienia kliniczne
Jakie jest znaczenie podanych wyżej informacji w praktyce klinicznej? Próbując odpowiedzieć na powyższe pytanie, profesor Lyndon Jones (University of Waterloo) badał implikacje kliniczne i strategie postępowania z osadami na soczewkach kontaktowych.
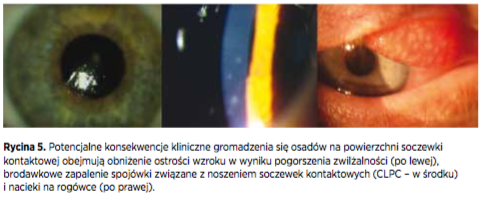
W przypadku starszych i rzadziej wymienianych soczewek, ostrość wzroku była obniżona przez osady, nie dzieje się tak w przypadku nowszych, częściej wymienianych soczewek kontaktowych, ponieważ ilość osadów nie osiąga podobnych poziomów. Słaba zwilżalność (Rycina 5) może wpływać na jakość widzenia u niektórych pacjentów, w szczególności pod koniec okresu użytkowania soczewki i pod koniec dnia, jednak dla większości użytkowników nie stanowi to problemu.
Dopóki białka zachowywały aktywność, wystąpienie brodawkowego zapalenia spojówki związanego z noszeniem soczewek kontaktowych (CLPC) było mało prawdopodobne (Rycina 5). Po denaturacji białka, istniała potencjalna możliwość wystąpienia zmian na powiece i wystąpienia odpowiedzi zapalnej w komórkach i w filmie łzowym. Obecność lizozymu po denaturacji była silnie skorelowana z dyskomfortem.
Przeprowadzone niedawno badania kliniczne wskazują na potencjalną rolę osadów w procesie rozwoju nacieków rogówkowych (Rycina 5). Stosowanie soczewki silikonowo-hydrożelowej planowej wymiany wykazuje dwukrotnie wyższy wskaźnik nacieków niż soczewki hydrożelowej, natomiast stosowanie soczewki jednodniowej wykazuje efekt ochronny w porównaniu do stosowania soczewki planowej wymiany, co potwierdzono w ramach kilku badań. Codzienna wymiana soczewek kontaktowych wiąże się z rzadszym występowaniem zdarzeń niepożądanych, szczególnie w przypadku materiałów z grupy IV. Postawiono zatem pytanie, czy większa częstość występowania nacieków podczas stosowania soczewek wykonanych z materiałów silikonowohydrożelowych może wiązać się z osadzaniem się składników filmu łzowego czy występowaniem pewnych czynników obecnych w filmie łzowym u niektórych użytkowników? To zagadnienie wymaga dalszej uwagi badaczy.
Pomyśl o jakości, a nie o ilości
Profesor Jones podaje trzy opcje postępowania z osadami w warunkach klinicznych: dobór materiału, częstotliwość wymiany i schemat pielęgnacji soczewek.
Profil osadów występujących na materiałach hydrożelowych jest całkowicie inny niż w przypadku materiałów silikonowohydrożelowych. Na materiałach hydrożelowych osadza się większa ilość białek, ale większość z nich zachowuje postać aktywną. Hydrożele z grupy IV przyciągają najwięcej osadów białkowych, jednak odsetek białek, które uległy denaturacji jest najniższy, a ilość osadów tłuszczowych –bardzo mała.
Na materiałach silikonowo-hydrożelowych (SiH) osadza się więcej tłuszczów i dużo mniej białek, a większość z nich ulega denaturacji, w szczególności po 3-4 tygodniach noszenia soczewek.
Dla niektórych pacjentów, rozwiązaniem mogą być materiały przyciągające selektywnie „dobre” tłuszcze. Badania w warunkach in vitro wykazały bardzo niewielki pobór cholesterolu przez soczewki z etafilconu A. Dużo większe ilości osiadały w szybkim tempie na soczewkach silikonowo-hydrożelowych, w szczególności u pacjentów, których film łzowy zawierał duże ilości cholesterolu jak na przykład miało to miejsce u osób z dysfunkcją gruczołów Meiboma.
Wprowadzenie etapu mechanicznego czyszczenia przez pocieranie i spłukiwania do schematu pielęgnacji soczewek może znacząco ograniczać ilość osadów białkowych, jednak samo pocieranie powierzchni soczewki ma ograniczony wpływ na usuwanie tłuszczów.
Podsumowując, metody postępowania dostępne w warunkach klinicznych obejmują zmianę materiału z silikonowohydrożelowego na hydrożelowy lub z hydrożelu neutralnego na materiał z grupy IV, na którym osadza się więcej potencjalnie dobroczynnych białek. Zalecane jest również skrócenie okresu użytkowania soczewek lub przejście na soczewki jednodniowe, oczyszczanie soczewek o dłuższym schemacie wymiany przez pocieranie i spłukiwanie oraz stosowanie roztworów zawierających surfaktanty.
Jak stwierdził prof. Jones „Być może pomyliliśmy się, co do osadów. Składniki filmu łzowego osadzają się nie bez przyczyny. Powinniśmy poszukiwać materiałów i rozwiązań, pozwalających na selektywne osadzanie się pożądanych składników, a jednocześnie odpornych na działanie składników niepożądanych”.
Anna Sulley jest Wicedyrektorem Global Strategic Medical Affairs w regionie EMA Johnson & Johnson Vision Care Companies
Tłumaczył: Piotr Kamiński Redakcja: Mgr Sylwia Chrobot Kierownik ds. Rynku Medycznego Johnson & Johnson Vision Care Companies Polska i Kraje Bałtyckie
